جدول تناوبی
جدول تناوبی شیمی یک جدول بسیار مهم است که با نام جدول مندلیف نیز شناخته می شود.در این مقاله قصد داریم تاریخچه جدول تناوبی و اندکی توضیحات راجب جزئیات این جدول جادویی را برای شما ارائه دهیم تا باعث شویم آگاهی شما نسبت به این جدول افزایش یابد تا بتوانید از آن استفاده مفید کنید و نتیجه بگیرید.
جدول تناوبی،از ابتدا تا انتها
آنتوان لاوازیه اولین فردی بود که ۳۳ عنصر شیمیایی را معرفی و لیست کرد.همینطور توسط دانشمندان مختلف این عناصر به صورتهای مختلف چیده شدند تا اینکه در سال ۱۸۶۹، مندلیف ۶۳ عنصر را با استفاده از قانون تناوب در یک جدول کنار یکدیگر قرار داد که آن جدول به جدول مندلیف یا جدول تناوبی مشهور شد.
از آن روز به بعد رقابت بین دانشمندان برای پر کردن جاهای خالی این جدول شدت یافت که این رقابت باعث به تکامل رسیدن این جدول شد.
جدول جادویی
جدول مندلیف، عناصر شیمیایی را بر اساس عدد اتمی، آرایش الکترونی و ویژگی های شیمیایی به نمایش می گذارد.عنصر ها در جدول تناوبی از عدد اتمی کمتر تا عدد اتمی بیشتر مرتب شده اند.
پیش بینی های مندلیف
دیمتری مندلیف جاهای خالی را در این جدول گذاشته بود که هنوز عناصر آن کشف نشده بودند.این دانشمند توانست با علم خود سه عنصر را با دقت بالا پیش بینی کند که صحت آن بعد از چندین سال مشخص شد.
او عناصری با نام های اِکا سیلیس، اِکا بور و اِکا آلومینیوم را پیش بینی کرده بود که بعد ها این عناصر با نام های ژرمانیم، اسکاندیم و گالیم در جدول تناوبی جایگذاری شدند.
چینش عناصر
در ابتدا چینش این جدول بر اساس وزن بود که این موضوع باعث بی نظمی در چینش شده بود.برای مثال وزن اتمی تلوریم بیشتر از ید بود و ید باید بعد از تلوریم در جدول قرار می گرفت.
دانشمندی با نام هنری موزلی با انجام آزمایش طیف سنجی پرتو ایکس آمد و باعث ایجاد اعداد اتمی شد و بعد از آن یک نظم دقیق در این جدول حاکم شد.
قالب نهایی جدول
در طول این سالیان هر بار فرمت و قالب این جدول دستخوش تغییر بوده است.امروزه هم بحث بر سر قالب نهایی وجود دارد اما نسخه نهایی این جدول که در دانشگاه ها و مدارس تدریس می شود جدول زیر است که عکس آن را برای شما قرار داده ایم.
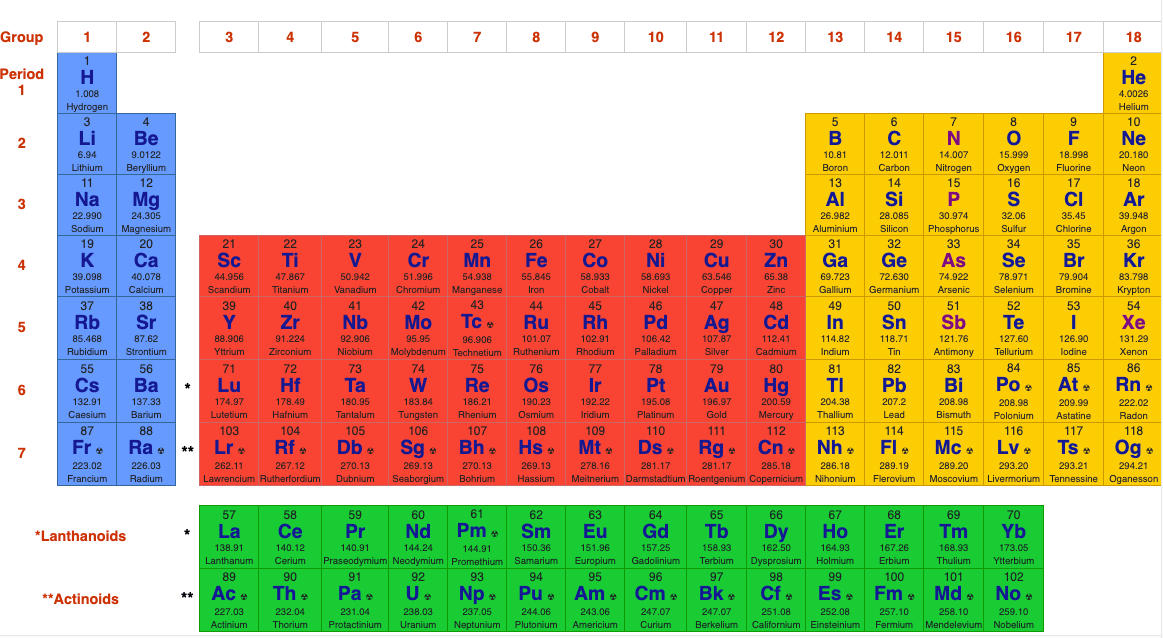
کشف عناصر
با پیدایش ۴ عنصر جدید توسط دانشمندان مختلف، آنها موفق به تکمیل کردن ردیف هفتم شدند.این عناصر عنصر های شماره ۱۱۳، ۱۱۵، ۱۱۷ و ۱۱۸ هستند که با نام های نیهونیوم، مسکوویم، تنسین و اوگانسون شناخته می شوند.
عنصر ۱۱۹
در آخرین همایش برگزار شده در ۴ سال پیش، گفتگوهایی برای ساخت عنصر ۱۱۹ انجام شد.دانشمندان برای انجام این کار قصد دارند عنصر کوریوم را توسط یون های وانادیم بمباران کنند.دانشمندان قصد دارند در صورت موفقیت برای کشف عنصر ۱۱۹ که در ردیف هشتم جدول قرار می گیرد، به تلاش برای دستیابی به عنصر ۱۲۰ نیز بپردازند.
بیشتر بدانید
معرفی جزئی جدول تناوبی شیمی
در جدول مندلیف، عناصر از چپ به راست در ۱۸ گروه و از بالا به پایین در ۷ دوره، قرار می گیرند.یک نوع دیگر دسته بندی وجود دارد که بر پایه لایه های الکترونی در حال پر شدن است.
گروهای جدول تناوبی
در یک گروه که در جدول تناوبی به صورت عمودی نمایش داده می شود، عناصر از ویژگی های تقریبا یکسانی برخوردارند و همچنین یکسان بودن آرایش آخرین لایه الکترونی هر گروه، از دیگر ویژگی های آن است.با بالا رفتن عدد اتمی، این شباهت ها نیز بیشتر و بیشتر می شود.
گروه ها از چپ با فلز های قلیایی شروع شده و به آخرین گروه یعنی گروه ۱۸ که گازهای نجیب نام دارند ختم می شوند.قبلا شماره گروه ها با اعداد رومی نمایش داده می شد اما هم اکنون این روش منسوخ شده است و دیگر کاربردی ندارد.
ویژگی های عناصر یک گروه
عنصر های یک گروه از نظر انرژی یونش و شعاع اتمی با یکدیگر متشابه اند.در یک گروه، از بالا به پایین، شعاع اتمی عناصر افزایش می یابد و این اتفاق باعث دور شدن فاصله الکترون های موجود در لایه آخر از هسته می شود.همچنین از بالا به پایین، از انرژی یونش عناصر کاسته می شود به این علت که جدا کردن الکترون ها از هسته آسان تر است.
دوره در جدول تناوبی شیمی
دوره ها همان ردیف های افقی موجود در جدول مندلیف هستند.در یک دوره از چپ به راست با کاهش شعاع اتمی روبرو هستیم و به این دلیل الکترون ها به سمت هسته کشیده می شوند که با افزایش یافتن عدد اتمی، به تعداد پرتون ها اضافه می شود.
کاهش در شعاع اتمی باعث افزایش انرژی یونش نیز می شود.علت این اتفاق محکم بودن پیوند ها در یک عنصر است که نیازمند انرژی بیشتری برای جداسازی الکترون هاست.
بلوک ها در جدول تناوبی
جدول مندلیف دارای بلوک است که به توضیح هر کدام به صورت جداگانه می پردازیم
- بلوک F
این بلوک دربرگیرنده اکتینید ها و لانتانیدهاست.
- بلوک D
از گروه ۳ تا گروه ۱۲ و تمامی فلزات واسطه را بلوک d پوشش و دربر می گیرد.
- بلوک P
این بلوک شش گروه اخر(۱۳ تا ۱۸) را دربر می گیرد.نافلزات و شبه فلزات در این بلوک قرار می گیرند.
- بلوک S
بلوک s در برگیرنده دو گروه اول جدول که شامل عناصر قلیایی و قلیایی خاکی و عناصر هیدروژن و هلیم می باشد.
لانتانید ها و اکتینید ها توسط دو ردیف به صورت جداگانه به پایین جدول اضافه شده اند.
شعاع اتمی عنصر های واسطه
در عنصر های واسطه در لحظه شروع پر شدن لایه d، شعاع اتمی کم می شود که اندازه این کاهش از اندازه کاهش عنصر های گروه دوم نسبت به گروه اول خیلی کمتر است. ولی در اتم های انتهایی این روند به صورت افزایشی است.
پایان مقاله آموزشی آشنایی با جدول تناوبی (جدول مندلیف)
هر فرد برای موفقیت در تحصیل و کنکور، نیازمند داشتن یک همراه است.خدمات سایت دانش پژوه همراه رایگان شما در این مسیر است.
یک مشاور و معلم برای موفقیت در شغلش نیازمند استفاده از خدمات دانش پژوه است، خدماتی که راه را برای شما هموارتر می کند.
جهت آشنایی و استفاده از این خدمات ارزشمند و رایگان، به لینک زیر مراجعه کنید


ارسال یک پاسخ